解淀粉芽孢杆菌对水中丁草胺的降解及影响
| 论文类型 | 基础研究,... | 发表日期 | 2008-02-01 |
| 来源 | 《环境科学研究》Research of Environmental Sciences Vol.18, | ||
| 作者 | 谭文捷,李发生,杜晓明,谷庆宝,何绪文 | ||
| 关键词 | 解淀粉芽孢杆菌;丁草胺;腐殖酸;生物降解 | ||
| 摘要 | 用解淀粉芽孢杆菌(Bacillus amyloliquefaciens)作为试验菌种,对除草剂丁草胺(N-丁氧甲基氯-2′-氯-2′,6′-二乙基乙酰替苯胺)在水介质中的微生物降解进行了研究。筛选了解淀粉芽孢杆菌降解丁草胺的最佳试验条件,研究了不同初始pH和添加外源腐殖酸对丁草胺微生物降解的影响。用高效液相色谱法(HPLC)检测了丁草胺残留量和降解产物,用红外光谱法(FTIR)分析测定了反应前后腐殖酸的变化情况。结果表明:解淀粉芽孢杆菌对丁草胺具有明显的降解效果,丁草胺初始质量浓度越高,其降解速率和降解效 | ||
谭文捷1,李发生2*,杜晓明2,谷庆宝2,何绪文1
(1.中国矿业大学(北京校区)化学与环境工程学院,北京 100083;
2.中国环境科学研究院土壤污染与控制研究室,北京 100012)
摘要:用解淀粉芽孢杆菌(Bacillus amyloliquefaciens)作为试验菌种,对除草剂丁草胺(N-丁氧甲基氯-2′-氯-2′,6′-二乙基乙酰替苯胺)在水介质中的微生物降解进行了研究。筛选了解淀粉芽孢杆菌降解丁草胺的最佳试验条件,研究了不同初始pH和添加外源腐殖酸对丁草胺微生物降解的影响。用高效液相色谱法(HPLC)检测了丁草胺残留量和降解产物,用红外光谱法(FTIR)分析测定了反应前后腐殖酸的变化情况。结果表明:解淀粉芽孢杆菌对丁草胺具有明显的降解效果,丁草胺初始质量浓度越高,其降解速率和降解效率也越高,碱性条件下丁草胺的降解率明显比酸性条件下高;腐殖酸的加入不仅能吸附丁草胺还能促进细菌对丁草胺的微生物降解,并能影响丁草胺的微生物降解产物。
关键词:解淀粉芽孢杆菌;丁草胺;腐殖酸;生物降解
中图分类号:X592 文献标识码:A 文章编号:1001-6929(2005)03-0071-04
Biodegradation of Herbicide Butachlor in Water Media UsingBacillus amyloliquefaciens
TANWen-jie1, LI Fa-sheng2, DUXiao-ming2, GUQing-bao2, HE Xu-wen1
(1.School of Chemical and Environmental Engineering, China University of Mining&Technology, Beijing 100083, China;
2.Department of Soil Pollution Control, Chinese Research Academy of Environmental Sciences, Beijing 100012, China)
Abstract: Biodegradation of herbicide butachlor (N-butoxymethyl-2′-chloro-2′, 6′-diethy lacetanilide) in aqueous media usingBacillus
amyloliquefacienswas investigated. The conditions for butachlor biodegradation were optimized. Effects of different initial pH values and addition of humic acids (HAs) on biodegradation of butachlorwere studied. The variation of butachlor residues and biodegradation productswas analyzed by high performance liquid chromatography (HPLC). The change of HAs under different reaction conditions was determined by fourier transform infra red (FTIR) spectroscopy. It was demonstrated thatBacillus amyloliquefacienscan degrade butachlor efficiently. Degradation rate increased with the initial concentrations of the tested herbicide and media pH. The addition of exogenous HAs can enhance the adsorption of butachlor, accelerate the biodegradation process of butachlor, and affect the biodegradation products in the meantime.
Key words:Bacillus amyloliquefaciens; butachlor; humic acids; biodegradation
丁草胺(N-丁氧甲基氯-2′-氯-2′,6′-二乙基乙酰替苯胺)是一种高效的选择性芽前除草剂。目前丁草胺已成为中国和世界水稻田首选的除草剂与杀稗剂之一[1]。丁草胺的大量使用必然会对环境产生一定的影响。丁草胺在自然界降解较快,其降解一般是依赖微生物和化学反应的共同作用[2]。已有的研究表明,丁草胺水解速度很慢[3],光稳定性好[4],不易被紫外线分解。环境中丁草胺的降解主要是由于微生物作用[5-6]所致。笔者采用从土样中分离纯化出来的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)作为试验菌种,研究丁草胺在水介质中的微生物降解过程,筛选解淀粉芽孢杆菌降解丁草胺的最佳试验条件,研究初始pH和添加外源腐殖酸等对丁草胺微生物降解过程的影响。
1 材料与方法
1.1 材料
土样采自北京市昌平区水稻田,丁草胺标样购于国家农药质检中心,其质量分数为93.1%。基础培养液:0.2 g MgSO4·7H2O, 0·001 g FeSO4·7H2O, 0·1gK2HPO4,0·1 g (NH4)2SO4和0·04 g CaSO4,加重蒸馏水至1 L,pH调至7·0。腐殖酸是采用标准方法[7]从北京水稻土中提取的,所用菌种是从北京水稻土中分离纯化出来的。经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
解淀粉芽孢杆菌形态特征:革兰氏阳性;菌体杆状、形成芽孢,芽孢卵圆形,孢囊膨大;最适生长温度为28~30℃。生理生化性质:还原硝酸盐;水解淀粉;可发酵D-葡萄糖,L-阿拉伯糖,甘露醇,D-木糖;接触酶阳性;氧化酶阴性。
图1为自土壤中提取的解淀粉芽孢杆菌显微观察照片。其中,图1(a)为放大1500倍条件下革兰氏染色后的光学显微镜照片,图1(b)为细菌的扫描电镜照片。图1(b)中,杆状的为菌体,长度约为3μm;卵圆形膨大的是芽孢,体型较小。

1.2 主要仪器和设备
YXQG01型蒸汽灭菌锅;HITACHI D-2500型高效液相色谱仪,带L-4200型紫外检测器;FTIR红外光谱仪(Nicolet 5PC,software Omnic1.2b);HZQ-C空气浴振荡器;HITACHI S-570扫描电子显微镜和BH-A型光学显微镜。
1.3 操作方法
反应液的配制:取2 mL 1 g/L的丁草胺储备液加入到装有10 mL制备好的菌悬母液的100 mL容量瓶中,用基础培养基定容后转移到250 mL锥形瓶中,用0.1 mol/L的盐酸和氢氧化钠调节溶液的pH(依次为5,6,7,8和9)。将锥形瓶放入空气浴摇床中,控制温度30℃避光培养,间隔一定时间取样。将取出的样品过0·45μm滤膜后,用高效液相色谱法测定丁草胺质量浓度随时间的变化情况,检测波长为215 nm,灵敏度为0.02 AUFS,色谱柱为Hypersil BDS C18(5μm) 4.0mm×200 mm,流动相为V(乙腈)∶V(水)=90∶10,流速为1 mL/min,进样量10μL。该条件下,丁草胺的保留时间为4.3 min。分析方法的线性范围为0·1~20mg/L,相关系数为0.999。反应一段时间后,用HPLC检测降解产物。
2 结果与讨论
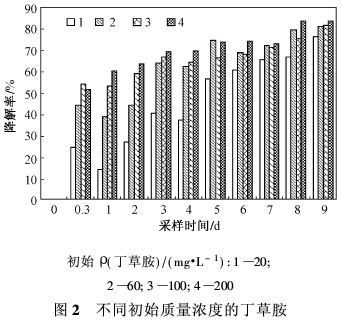
2.1 初始质量浓度对丁草胺微生物降解的影响图2是不同初始质量浓度的丁草胺对微生物降解率的影响。从图2可以看出,丁草胺初始质量浓度较低时的降解率明显低于初始质量浓度高的情况,且开始时降解较快,降解率较高。6 d后降解率变化不明显,可能是由于微生物数量的减少,使丁草胺的降解减慢。由于各初始质量浓度对微生物的降解都很明显,因此选取20 mg/L作为后续试验质量浓度。
2.2 不同细菌接种量对丁草胺微生物降解的影响图3是不同细菌接种量对丁草胺微生物降解的影响。从图3可以看出,随着细菌接种量的增加,丁草胺的降解率逐渐增加,当细菌接种量为5和10 mL时,其降解率变化不明显。因此,试验选取5 mL作为最佳接种量。

2.3 初始pH对丁草胺微生物降解的影响
表1是丁草胺在不同初始pH水体中的微生物降解动力学试验结果。线性回归分析表明,在不同pH水体中,丁草胺的微生物降解反应均遵从一级反应动力学方程,回归分析的相关系数均在0·9以上,符合农药生物降解的一般规律[2]。从表1可以看出,水溶液的碱性越强,微生物降解的速率越快;酸性越强,降解速度越慢。
表1 丁草胺在不同初始pH水体中的微生物降解动力学
Table 1 The kinetic results of biodegradation of butachlor under different initial pH
| 初始pH | 回归方程 | 相关系数(R) | 半衰期(t1/2)/d |
| 5 | C=9.5238e-0.1604t | 0.9884 | 4.0 |
| 6 | C=10.912e-0.2044t | 0.9794 | 3.8 |
| 7 | C=8.7147e-0.2415t | 0.9554 | 2.3 |
| 8 | C=9.5571e-0.3805t | 0.9202 | 1.7 |
| 9 | C=10.617e-0.4844t | 0.9494 | 1.5 |
注:C为丁草胺质量浓度,mg/L;t为采样时间,d。
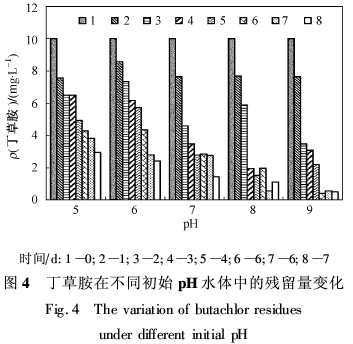
将不同pH水体中丁草胺的残留量随时间的变化规律绘制成图4。从图4可以看出,随着碱性的增强,丁草胺的残留质量浓度下降速率明显加快,且最终降解率较高。说明在酸性条件下,丁草胺微生物降解速率缓慢;而在碱性条件下,其降解速率较快。
2.4 腐殖酸对丁草胺微生物降解的影响
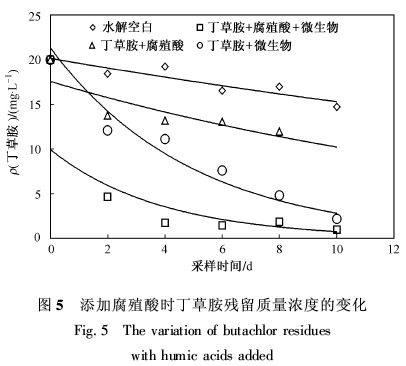
图5为在加入腐殖酸的水体中丁草胺降解残留量变化情况。由图5可以看出,在空白水体中,丁草胺水解速度缓慢。在添加腐殖酸的水体中,腐殖酸对丁草胺的吸附在2 d后达到平衡,平衡后丁草胺残留质量浓度变化缓慢。在接种微生物的水体中,丁草胺的降解速率明显比水解速度快,说明丁草胺的降解主要是微生物降解。而在接种微生物的水体中加入腐殖酸,使丁草胺的质量浓度迅速下降,是所有对比样中质量浓度最低的。说明腐殖酸对丁草胺的微生物降解有很大的促进作用。原因可能是加入的腐殖酸除了发挥吸附作用外,还充当了一种表面活性物质的作用,加速了丁草胺在水溶液中的分散,使微生物与丁草胺充分接触并得到降解;另一种可能是加入的腐殖酸作为一种载体,在吸附丁草胺的同时,也吸附微生物,细菌附着在腐殖酸的表面形成生物膜,增加了细菌与丁草胺接触的可能,从而加速其降解。
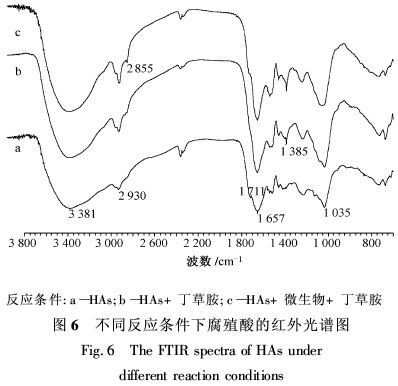
将不同反应条件下的腐殖酸进行红外分析,得到图6,各吸收峰的归属[8-10]见表2。由于腐殖酸吸附丁草胺的量较低,吸附前后红外光谱的变化不十分明显,即图6中曲线a,b和c出现吸收峰的波数大致相同,峰面积相近。但在波数为2 855和1 385 cm-1附近,图6中3条曲线的峰面积有明显的差异,即吸附丁草胺后在该波数的吸收峰面积明显增加。1 657 cm-1代表C O伸缩振动吸收峰,而1 035 cm-1代表C—O的变形振动吸收峰,面积变小说明该基团受到干扰,即吸附后腐殖酸的羰基(C O)及酚醇羟基(O—H)与丁草胺形成氢键。说明形成氢键是腐殖酸吸附丁草胺的主要作用。曲线c与b相比,在2 855 cm-1处出现明显的吸收峰,在1 385 cm-1处吸收峰明显增强,说明在该波数处腐殖酸对反应物有明显的吸附作用,微生物的加入对腐殖酸的吸附作用影响不大。
2.5 产物分析
2.5.1 丁草胺的微生物降解产物
用高效液相色谱法检测丁草胺微生物降解产物(见图7),发现在该试验时间范围内,除峰1为丁草胺母体外,还出现了5个主要产物峰,分别为峰2~6。说明丁草胺的微物生降解产物不是单一的,具有多样性。


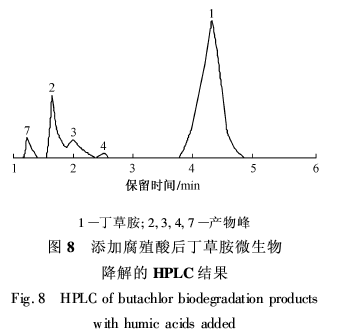
2.5.2 添加腐殖酸后丁草胺的微生物降解产物图8是添加腐殖酸后丁草胺微生物降解的HPLC结果。与图7相比,图8中产物峰的峰型和数量都存在明显差异,缺少图7中峰5和峰6两种产物,但又增加了一种新的产物(峰7);而且丁草胺的峰面积也比图7中的小得多,这是由于腐殖酸对丁草胺的吸附作用所致。比较图7,8表明,腐殖酸不仅能吸附丁草胺,加速丁草胺的微生物降解过程,而且还能影响丁草胺的微生物降解产物,其机理还有待于进一步研究。
3 结论
a.在解淀粉芽孢杆菌-丁草胺微生物降解体系中,不同pH条件下丁草胺的微生物降解反应遵从一级反应动力学方程,水体的碱性越强,微生物的降解速率越快;酸性越强,降解速率越慢。
b.在解淀粉芽孢杆菌-丁草胺体系中,腐殖酸的加入能加速丁草胺的微生物降解。原因可能是加入的腐殖酸除了发挥吸附作用外还充当了一种表面活性物质的作用,加速了丁草胺在水溶液中的分散,使得微生物与丁草胺充分接触并得以降解;另一种可能是加入的腐殖酸作为一种载体,在吸附丁草胺的同时,也吸附微生物,细菌附着在腐殖酸的表面形成生物膜,增加了细菌与丁草胺接触的可能性,从而加速其降解。c.高效液相色谱分析结果表明,腐殖酸不仅能加速丁草胺的微生物降解过程,而且还能影响丁草胺的微生物降解产物。
参考文献:
[1] 唐除痴.农药化学[M].天津:南开大学出版社,1998.Tang Chuchi.Pesticide chemistry[M].Tianjin:Nankai University Press,1998.
[2] 夏北成.环境污染物生物降解[M].北京:化学工业出版社,2002.Xia Beicheng. Biodegradation of contamination in environment [M].Beijing:Chemical Industry Press,2002.
[3] 姚斌,徐建民,张超兰.除草剂丁草胺的环境行为综述[J].生态环境,2003,12(1):66-70.Yao Bin,Xu Jianmin,Zhang Chaolan.Behavior of herbicide butachlor in environment[J].Ecology and Environment,2003,12(1):66-70.
[4] Zheng H,Ye C.Photodegration of acetochlor and butachlor in waters containing humic acid and inorganic ion [J]. Bull Environ Contam Toxicol,2001,67:601-608.
[5] Yu Y L,Chen Y X,Luo Y M.Rapid degradation of butachlor in wheat rhizosphere soil[J].Chemosphere,2003,50:771-774.
[6] Chen Y L,Wu T C.Degradation of herbicide butachlor by soil microbes[J].J Pesticide Sci,1987,3:411-417.
[7] 李克斌.土壤腐殖酸的提取及表征[J].陕西化工,1998,27(4):11-13.
Li Kebin.Extraction and characterization of humic acid in soil[J].Shanxi Chemical Industry,1998,27(4):11-13.
[8] Senesi N,Dorazio V,Ricca G.Humic acids in the first generation of Eurosoils[J].Geodema,2003,116:325-344.
[9] Mansuy Laurence.Characterization of humic substances in highly polluted river sediments by pyrolysis methylation_gas chromatography_mass spectrometry[J].Organic Geochemistry,2001,32:223-231.
[10] Reveille Veronique.Characterization of sewage sludge_derived organic matter:lipids andHAs [J].Organic Geochemistry,2003,34:615-627.
收稿日期:2004-08-12
基金项目:国家重点基础研究发展计划项目(2003CB415007);国家重点
基金研究发展计划前期研究项目(2001CCB00700)
作者简介:谭文捷(1980-),女,山东烟台人,硕士研究生.
*通讯联系人
相关推荐
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 [email protected] ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








