接触氧化除铁规律的研究
| 论文类型 | 技术与工程 | 发表日期 | 2001-07-01 |
| 来源 | 贺李圭白院士七十寿辰学术论文集 | ||
| 作者 | 李继震 | ||
| 关键词 | 氧化除铁 | ||
| 摘要 | 在试验和生产的基础上,对现在普遍采用的接触氧化除铁基本方程式进行修正和补充,提出新的基本方程式,建立了除铁水含铁量与滤池工作时间的函数关系,并指出系数n的影响因素。此外,还对滤潜水铁质的形态对除铁效果的影响、pH值的变化和滤料总表面积与除铁水水质的关系等规律作了探讨。 大多数地下水除铁水厂都采用接触氧化除铁方法。新滤料投产后有一段成熟期,成熟后的滤料依靠活性滤膜除铁,而滤料本体仅在成熟期中有一定的化学和物理作用,在正常生产中仅为活性滤膜的载体使用。活性滤膜具有强烈且稳定的接触氧化除铁作用,因而具有接 | ||
李继震
摘 要:在试验和生产的基础上,对现在普遍采用的接触氧化除铁基本方程式进行修正和补充,提出新的基本方程式,建立了除铁水含铁量与滤池工作时间的函数关系,并指出系数n的影响因素。此外,还对滤潜水铁质的形态对除铁效果的影响、pH值的变化和滤料总表面积与除铁水水质的关系等规律作了探讨。
大多数地下水除铁水厂都采用接触氧化除铁方法。新滤料投产后有一段成熟期,成熟后的滤料依靠活性滤膜除铁,而滤料本体仅在成熟期中有一定的化学和物理作用,在正常生产中仅为活性滤膜的载体使用。活性滤膜具有强烈且稳定的接触氧化除铁作用,因而具有接触氧化除铁的独特规律。根据试验研究的结果和对生产现象长期的观察,本文就接触氧化除铁的一些规律,作以论述。
1.1 现行接触氧化除铁基本方程式
现在被人们普遍采用的接触氧化除铁基本方程式为
![]() (2)
(2)
![]() ; (3)
; (3)
式中 β —接触氧化除铁活性系数
β′—除溶解氧、滤速、粒径之外,其他因素影响的除铁活性系数
р—指数,取决于水的运动状态,其值在0~1范围内,可由试验确定
式中反映出铁水含铁量[Fe2+]与原水中含铁量[Fe2+]0、滤层深度x、当量粒径d、原水溶解氧浓度[O2]、滤速v之间的函数关系,能够深刻反映出某一时刻除铁的规律,但是,实际上在不同时刻除铁水的含铁量是不同的,随着滤池工作时间而有规律的变化(见图1),这些变化在公式中没有体现出来。
1.2 [Fe2+]随时间T变化的原因及规律
接触氧化除铁的水化学反应过程是Fe(OH)3•2H2O作为催化剂的表面自动接触催化过程,所以催化能力的大小与附着在滤料表面(与水接触部分)Fe(OH)3•2H2O的数量成正比,反冲洗后刚投入运行滤池的滤料表面,只保留少部分必要的具有催化活性的Fe(OH)3•2H2O滤膜,而大部分滤膜在反冲洗中被冲掉了,由于数量有限,所以除铁效果较差。又因为除铁过程式自动接触催化反应,所以随着工作时间T的增长,滤料表面上生成并积累的Fe(OH)3•2H2O的数量不断增多,催化能力不断增大,除铁效果也越来越大。
通过几个月的滤管试验,得出了出水含铁量与过滤时间的关系,以其中一组为例进行探讨。d=1.585mm、K<1.3、H=0.83m、[Fe2+]=10mg/L、v=7.3m/h、pH=6.2、水温6℃、[O2]=8mg/L,除铁水含铁量与时间的关系见图1。
从图中可以看出,除铁水含铁量随着反冲洗后滤池的工作时间而有规律的变化着。
1.3 基本方程式的建立
由式(3)得
![]()
![]() (4)
(4)
根据试验得到的数据,利用式(4)进行计算,得出试验中各不同时刻滤料的除铁活性系数 β ,绘出 β 与T的关系曲线,见图2。
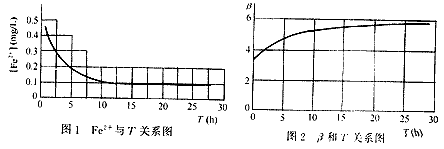
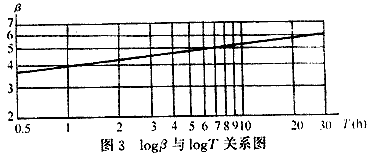
图2中,β为时间T的函数,进一步建立logβ与kogT 的关系图像,见图3。
图3的图像为一条直线,建立该直线的方程式
log β-log β1=n(logT-log1)
式中 n——直线的斜率,本组实验n=0.123
β1——反冲洗后滤池工作1h(即T=1),滤池的除铁活性系数
β——反冲洗后滤池工作T小时,滤池的除铁活性系数
整理上式
log β=log β1+nlogT
log β=lpg β1Tn
β= β1Tn
将式(5)分别代入式(3)、(2)、(1)得
![]()
![]()
![]()
式中β′—反冲洗后滤池工作时间1h,除溶解氧、滤速、粒径之外,其他因素影响的除铁活性系数。
该方程式反映了出铁水含铁量与包括滤池工作时间在内的多元函数关系,即可用来深入理解除铁的规律,又可以用来做具体计算。
1.4 对n值的探讨
对于既定的滤床、原水水质和滤速,n值为常数。对于不同的滤床、原水水质和滤速,n值均有所差异。从50余组试验中,将具有典型意义的5组试验得出的n值,列于表1。
表 1 n值统计表
序号
当量粒径mm
原水含铁量mg/L
滤速m/L
n
1
1.256
14.2
15
0.116
2
1.585
14.2
15
0.110
3
1.585
10
7.3
0.123
4
1.585
10
12.8
0.118
5
1.256
10
12
0.129
分析水中数据,可得出如下结论:
1)原水含铁量相同、滤速相同,粒径越大、n值越小,如1组与2组、4组与5组。
2)原水含铁量相同、粒径相同, n值越小,如3组与4组。
3)粒径相同、滤速相同,原水含铁量越大、 n值越小,如2组与4组。
总之,粒径越大、滤速加大、原水含铁量加大时,n值减小。
2.1 原水中三价铁对处理效果的影响
与自然氧化法相反,接触氧化除铁法希望曝气后地下水中二价铁在位敬仰花钱直接进入滤层。假如滤前水中三价铁所占比例过大,能严重影响除铁效果。在同一滤床中作了对比试验,见表2。
表2 三价铁对接触氧化除铁效果影响对比表
序号
滤层当量粒径cm
原水含铁量mg/L
滤速
m/h
出水平均含铁量mg/L
除铁百分比%
总铁
三价铁
二价铁
三价铁占总铁
总铁
三价铁占总铁
二价铁
三价铁
总铁
1
1.256
10
0.9
9.3
9
14
0.143
70
99.53
89
98.57
2
1.256
6
2.0~2.8
2.2~4
33~47
10
0.3
65~70
96~97.4
90~92.5
95
从表中可以看出,第二组试验与第1组试验相比,尽管原水总含铁粮由10mg/L降到6mg/L,滤速由14m/h降到10m/h,但是出水含铁量反而增加了一倍多,由0.143mg/L增高到0.3mg/L,其原因是原水中三价铁的存在的比例过大造成的影响。从而说明了,三价铁对接触氧化除铁不但没有益处反而还有害处。
2.2 讨论
上述特征的存在,是由于接触氧化除铁原理所决定的。滤料表面的活性滤膜的主要成分是对水中Fe2+的氧化起接触作用的Fe(OH)3•2H2O,该化合物能与水中Fe2+进行离子交换吸附,其反应为:
Fe(OH)3.2H2O+Fe2+→Fe(OH)2.O.Fe2+.2H2O+H+
生成Fe2+与Fe2+的黑色复合物,在水中含有溶解氧时能迅速的进行水解和氧化反应,其反应为
Fe(OH)2.O.Fe+.2H2O+1/4O2+9/2H2O→2[Fe(OH)3.2H2O]+H+
又生成了新的Fe(OH)3•2H2O,所以其接触氧化除铁过程是一个自动催化反应过程,因而除铁效率非常高。水中三价铁在中性条件下是以氢氧化物沉淀形式存在的,而Fe(OH)3•2H2O不能与水中三价铁进行离子交换吸附,滤料对水中三价铁沉淀物的去除只能起到机械过滤作用,而且三价铁沉淀物没有很好的絮凝,因而去除效率低。从表2看出,原水中三价铁含量占总铁含量由9%增加到33~47%时,除铁效率由99.57%降为95%,同时对其中三价铁的去除率仅为90%左右。
此外,自然氧化生成的三价铁沉淀物,没有严密的化学结构,其分子式可用Fe(OH)3•nH2O表示,一般不具有接触氧化活性,所以与具有特殊结构的活性滤膜物质是不同的。从外观上,自然氧化生成的三价铁氢氧化物沉淀为土黄色,而在活性滤膜上生成的三价铁化合物为棕褐色,有明显不同。在过滤前的水中自然氧化生成的三价铁沉淀物进入滤池后,会附着在滤料表面积上,减少了具有强烈活性滤膜的表面积,影响了其对地下水中二价铁的去除能力。从表2中可以看出,原水三价铁含量由9%增加到33~47%时,使其中二价铁的去除率由99.53%降到96~97.4%。总之,滤前水中三价铁含量过大,对接触氧化除铁的效率影响很大。在这种滤前条件下,为了得到合格得出铁水,就必须大幅度降低滤速。
3.PH值的变化
自然氧化法除铁,水在曝气过程中pH值有所上升,在滤床中渗透时pH值不变。而接触氧化法除铁则情况有所不同,水在曝气时pH值有所提高,在滤床中渗滤pH值则有所下降。
由前述的接触氧化除铁反应方程式中可以看出,每个Fe2+离子可以置换出两个H+离子。假如原水含铁量为14mg/L,可置换出的氢离子浓度为0.5mgq/L,其数量相当可观。地下水是一种比较复杂的缓冲溶液,主要是碳酸盐和酸式碳酸盐构成的缓冲溶液,因而被置换出来的氢离子只能使在一定程度上使H+浓度增加、pH值降低,pH值下降的幅度一般可达0.2~0.4,这是不可忽视的变化。
依据滤前水的水质,可求出滤过水pH值,其计算式为
pH=pKa+log[HCO3-]-2[Fe2+]M)-log([H2CO3]+2[Fe2+]M (9)
式中 Ka——级碳酸电离平衡常数
[Fe2+]M —原水中二价铁的摩尔浓度
[HCO3-]、[H2CO3] —过滤前水中的[HCO3-]、[H2CO3]摩尔浓度
但是,实际上碳酸有可能被活性滤膜吸附,结果使计算得到的pH值产生误差,被吸附的二氧化碳数量难以确定,却引起的计算偏差也难以求得。实际上,计算出的pH值总是比实际值略低。
4. 滤料的总表面积与降铁水质的关系
每m2滤池面积里,滤料的总表面积为
[6(1-m)/φ].(x/d)
滤料选定后,其孔隙率m、球形度Φ为定值,则总表面积s是滤层深度x与当量粒径d的比值x/d的函数。
基本方程式(8)中,指数中的x/d即体现滤层的总表面积,而常数6(1-m)/Φ可以看作包含在系数β中,则滤料总表面积是决定接触氧化除铁效果的重要因素。式(8)反映出滤过水含铁量与x/d的函数关系,可为设计和生产提供较准确的数据。实验资料表明,同一水质,不论是一般滤床、反粒度滤床或者是均匀粒径滤床,只要s相同,即x/d相同,则除铁效果基本相同。但是,应指出,尽管它们的出铁效果一样,但是水力条件则各不相同,体现在水力损失及其增长的规律、含污能力、可选用的滤速及相应的工作周期等都各有不同。生产中,笔者曾选用大粒径均匀滤料,佳木斯自来水公司曾选用反粒度滤料,都是在s基本一样,除铁效果基本不变的前提下,取得了改善滤床的水力条件,增加滤池的含污能力,提高滤速,从而达到了提高处理水量的目的。
参 考 文 献
[1] 李圭白、刘超,“地下水除铁除锰”,中国建筑工业出版社,1989年
相关推荐
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 [email protected] ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








