吸附、降解组合生物系统处理含铜离子城市污水
| 论文类型 | 技术与工程 | 发表日期 | 2006-02-01 |
| 来源 | 中国水网 | ||
| 作者 | 吴晓林,王磊,高燕,苏耀东,李风亭 | ||
| 关键词 | 细胞生长相 细胞预处理 COD去除 COD吸附能力 Cu2+吸附 Pseudomonas putida | ||
| 摘要 | 采用Pseudomo ns putida 5-X细胞为吸附剂的生物吸附过程组合SBR生物降解系统处理含铜离子城市废水.研究了生物吸附剂Pseudomo ns putida 5-x细胞的最佳制备条件以及组合系统的运行过程.实验结果表明,在优化的条件下,Pseu.domo ns putida 5-x细胞对铜离子的吸附容量可达87.3mg·g-1,经生物吸附处理后,污水中cu 的含量显著降低,尽管残留的Cu2+对活性污泥吸附COD的能力尚有一定影响,但已不影响SBR系统对废水中COD的去除效果.研究表明,在活性 | ||
Combined Bio.Process for Treatment of M unicipal W astewater Containing CU ’
WU Xiao-lin,W ANG Lei,GAO Yan,SU Yao—dong,LI Feng—ting
(1.Department of Chemistry,Tongji University,Shanghai 200092,China;2.State Key Lab of Pollution Control& Resource Reuse,Tongji University,Shanghai 200092,China;3.Wuhan Designing Institute of China Light Industry,Wuhan 430063,China)
Abstract:A combined bioprocess consisting of biosorption section with P.putida 5一x cell as biosorbent followed by a SBR is deve1. oped tO treat Cu2+ containing municipal wastewater.The optimal preparing technique of P.putida 5-X cell as biosorbent is studied. Under the optimal condition.adsorption capacity of the P.putida 5-X cell tO Cu reached 87.3 mg·g-1.The performance of the combined bioprocess for treating Cu2+ containing wastewater is asses,sad.The experimental results indicate that after trea tment by the biosorption section,the Cu2+ concentration in wastewater reduced to the level that did not inhibit COD removal efficiency of subsequent SBR activated sludge process.although it still affectes the COD adsorption capacity of activated sludge.In terms of COD removal,the biosorption section is efficient for reducing Cu2+ concentration to provide biodegradable wastewater for subsequent SBR activated sludge proc ess.
Key words:cell growth phase;cell pretreatment;removal of COD;COD adsorbing capability;Cu2+ adsorbing;Pseudomonas putida
Cu2+是工业废水中最常见的重金属离子之一,研究表明,当污水中Cu2+浓度达到1.0mg·L-1以上时,活性污泥系统中微生物的生长就开始受到影响,达到10mg·L-1以上时,微生物生长受到明显抑制[1,2].因此,在进入活性污泥过程前,应将Cu2+浓度降到1.0mg·L-1或更低[3].
废水中重金属离子的传统处理方法有化学沉淀、离子交换、电化学法等.这些处理方法都有明显缺点,尤其当重金属离子浓度较低时(100mg·L-1以下),如去除不完全、处理剂消耗量大、产生环境有害污泥及成本高等,且加入的化学试剂将严重影响后续活性污泥的活性[4].近20年来,利用某些具有高吸附能力的微生物细胞从废水中吸附重金属离子的方法引起了人们的广泛关注,据报道,一些细菌、酵母菌、真菌和藻类等都可作为废水中的Cu2+,Ni2+,Pb2+ ,Zn2+ 等金属离子的吸附剂[5-8].在以前的研究中,筛选1株革兰氏阴性细菌Pseudomonas putida 5-x,研究表明该细菌对Cu2+和Ni2+有较高吸附能力[9,10],可以作为生物吸附剂用于从废水中吸附回收重金属离子.
本文介绍了进一步提高P.putida 5-x细胞吸附能力的细胞制备技术,并研究了其在生物吸附一生物降解组合系统处理含Cu2+废水时,对Cu2+的去除能力,以及残余的Cu2+对随后的SBR系统降解有机污染物的影响,并和单一的SBR处理含Cu2+废水作了比较.
1 材料和方法
1.1 Pseudomonas putida 5-x细胞吸附剂的制备和再生
本实验所用的生物吸附剂为电镀厂废水中分离出的革兰氏阴性细菌Pseudomonas putida 5-x(图1),该细菌具有较高的重金属离子吸附能力.将其接种到50mL LB培养基中,30℃ ,200r/min摇床培养24h.随后以1%的接种量接种于5种不同的培养基中(表1).于30℃ ,200r/min摇床培养12~48h.将培养液在4℃ ,4 000 r/min离心分离10min得到菌体,用100 mL pH为6.0的10mol·L-1MES缓冲液洗2次.预处理方法为每100mg P.putida 5-x细胞用25mL不同的洗涤液于25℃ ,200r/min振荡洗涤30min,再用50mL pH为6.0的10mol·L-1MES缓冲液洗涤.再生方法同预处理方法.

表1 5种培养基的配方
Table 1 Composition of five culture mediums
0.1
0.1 0.1 1.2 透视电镜(TEM)分析
处理后的细胞经离心,乙醇脱水后,固定在Spurr介质上,切成厚度为60nm 的薄片,进行透射电镜分析.使用电镜为JEM一1200EX—II(JEOL,日本).
1.3 吸附.降解组合生物系统及其操作
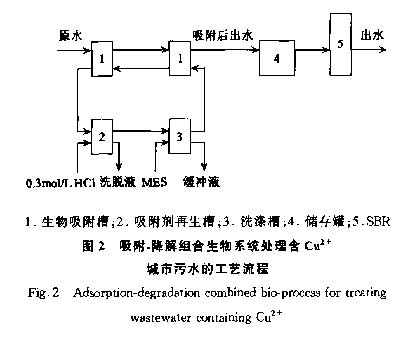
实验室所用的组合生物系统包括1个半连续生物吸附装置和1个序批式反应器(SBR).生物吸附装置由2个吸附槽、1个再生槽和1个洗涤槽组成.每个吸附槽容积为1L,内有磁子进行磁力搅拌.废水与生物吸附剂以对向的方式进入,即600mL含铜离子城市污水首先进入第1个吸附槽中,经20min搅拌吸附后静置10min,上清液进入第2个吸附槽进行二次吸附一沉淀操作,二次吸附后的上清液进入SBR反应器进行活性污泥法处理以去除COD.生物吸附剂首先进入第2个吸附槽中,经过一次吸附一沉
淀操作后再进入第1个吸附槽用于吸附,饱和后转入再生槽进行再生,再生后的吸附剂再进入第2个吸附槽,以此类推(见图2).SBR的容量为3L,设计MLVSS为2000~3000mg·L-1 ,运行周期为8h,包括4步:进水(10min,2L);反应(6.5 h);静置(1.0h);排出(20min,2L).
实验所配含各种Cu 浓度的城市污水的COD为800mg·L-1左右.
1.4 Cu 吸附等温线
取一定体积含Cu2+城市污水, Cu2+浓度分别为10mg·L-1 ,25mg·L-1 ,30mg·L-1,50mg·L-1,加入0.5g·L-1 生物吸附剂.测定吸附后污水中残留的Cu2+浓度,计算生物吸附剂对Cu2+的吸附容量,并绘制Cu2+的吸附等温线.
1.5 分析方法
细胞干重的测定:取100mL 培养液,经4 000r/min离心20min得到菌体,用蒸馏水洗涤2次,于80℃ 烘干至恒重,用电子天平称重.
培养液中的细胞生长情况通过测定培养液的OD600值确定.用Perkin Elmer 3300原子吸收仪测定Cu2+的浓度.根据APHA标准法测定COD和MLVSS[11].Cu2+的吸附容量根据下式计算:
Q-(Ci—Ce)V/W
Q 为Cu2+的吸附能力(mg·g-1);Ci为污水中Cu2+的初始浓度(mg·L-1);Ce为吸附后上清液中Cu2+的浓度(mg·L-1);W 为细胞干重(g);V为缓冲液体积(L).
2 结果和讨论
2.1 培养基成分对P.putida 5一X细胞吸附能力的影响
本研究中,使用了5种培养基培养P.putida 5一X细胞,并测定不同培养基培养的P.putida 5一X细胞吸附铜离子的能力.表2可见,硫和氮限制的培养基中生长的P.putida 5-X细胞对Cu2+的吸附能力显著提高.但培养基中氮含量低时P.putida 5一X生长速度较慢,故使用硫限制培养基培养P.putida 5-x细胞是最佳选择.以后的研究中细胞培养均采用硫限制培养基.
完全培养基培养的细胞中C,N,P,S的比例有一个相对固定值,一般细胞的C:N:P:S约为50:14:3:1[11].当培养基中硫和氮含量低时,细胞缺少S源或N源,正常合成和代谢功能受到限制,而细胞吸收的过量C源、P源不能加入正常的细胞生长代谢,只能合成为生长和代谢非必需的含碳和含磷的多糖和聚磷酸类化合物并储存在细胞内[12].多糖中的羰基和多磷酸盐中的膦酸脂都带有负电荷,是细胞表面吸附重金属的功能基团.所以在N和S限制培养基中生长的细胞表面组分中多糖和聚磷酸盐含
量较高,因此细胞吸附重金属的能力也显著提高.
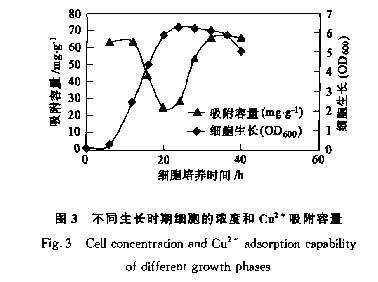
2.2 细胞生长周期对吸附能力的影响
在硫限制培养基中,P.putida 5-X的生长可分为4个阶段:停滞期(0~8h),对数增长期(10~24h),稳定期(26~36h)和衰亡期(38~44h)。32~34h时,细胞数量达到最大值;同时,在50 mg·L-1Cu2+溶液中测定不同生长期P.putida 5一X细胞的吸附重金属离子的能力,见图3.当细胞进入对数生长期时,对Cu2+的吸附能力逐渐降低,在24~26h时达到最低值24.8mg·L-1。.当细胞进入稳定生长期,对Cu2+的吸附能力逐渐升高,并在稳定生长期的后期加速上升.在稳定期的末期,P.putida 5一X对Cu2+的吸附能力达到最大值67.7mg·L-1。,在衰亡期细胞吸附能力再次降低.
表2 不同的营养限制对P.putida 5.x细胞生长和Cu2+吸附容量的影响
Table 2 Effect of nutrition limitation on cell growth and adsorption capability of P.putida 5一x
细胞吸附重金属的能力与细胞表面结构和组成有关[13,14].细胞表面组分中的脂多糖、蛋白质、肽聚糖和膦酸脂等都含有带负电荷的基团,如羰基、磷酸基和羟基等,都有利于吸附重金属[15].不同生长期的细胞表面组成不同,带有负电荷的基团的数量不同,因而吸附能力不同.在衰亡期,由于细胞自溶引起表面结构破坏,故吸附能力显著下降.
考虑到细胞产量和吸附能力,最佳收获期在培养36h左右.故本实验所用细胞均取自培养36h的培养液.
2.3 细胞预处理对Cu2+吸附的影响
使用不同的洗液对P.putida 5-x细胞进行预处理,与未进行预处理的细胞对比,发现经稀酸或(NH4)2SO4 洗涤后,细胞吸附Cu2+的能力提高11%~26%,而使用碱液或浓酸液洗涤,细胞吸附Cu2+的能力降低,见表3.实验结果表明0.1~0.3 mo1·L-1 HC1是最佳细胞预处理剂.
表3 预处理对细胞铜离子吸附容量的影响
Table 3 Effect of pretreatment on cell Cu adsorption capability
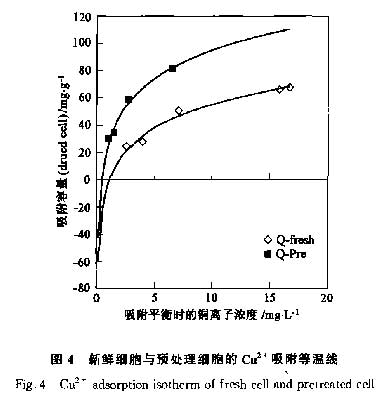
吸附实验显示,新鲜细胞和0.3mol·L-1 HC1预处理的细胞对Cu2+的吸附过程可以分别用公式Qp= 26.9Ce0.75和Qf=12.8Ce0.68 表示,见图4,这表明新鲜细胞和预处理细胞对Cu2+的吸附符合Freundlich吸附等温线方程Q=Kf·Cen,因此这一吸附过程是一个物理吸附过程.公式中Kf值代表了吸附剂的吸附能力[18],预处理细胞的Kf值为26.9,远大于新鲜细胞的Kf值12.8,也表明预处理细胞对Cu2+来说是一种比新鲜的P.putida 5-x细胞更好的吸附剂.
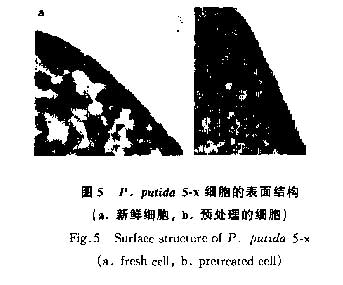
通过透射电镜(TEM)观察,发现未经预处理的细胞表面有一结构松散层(图5a),经0.3mol·L-1HC1处理后,该松散层被降解(图5b).细菌表面荚膜的含水率高达95%,由单层或多层糖和蛋白质组成.由于含水量高,荚膜中的这些聚合物很容易变形并向外伸展出几百nm,完全处于水中,很容易被洗涤液洗脱[16].用0.3mol·L-1HC1进行预处理以去除细菌表面的荚膜结构,可以使细胞外膜和肽聚糖层上的大量负电荷基团充分和Cu2+结合,从而提高对Cu2+离子的吸附能力.透射电镜分析表明,P.putida 5-x细胞经酸预处理后细胞表面结构松散的荚膜被降解,从而提高了P.putida 5-x吸附Cu2+的能力.用碱液或浓酸处理会彻底破坏细胞表面结构和成分从而使吸附能力降低.
理论上,荚膜中的糖和蛋白质都含有带负电荷的羰基和羟基,有利于与重金属结合成键,但由于电荷密度低,成键作用有限.Cu2+为二价离子,需2个带负电荷的吸附基团与之成键,由于细菌荚膜的含水量高导致其易变型,成键易引起荚膜表面构造发生变化[17],造成在细胞外膜和肽聚糖层上的一些可以结合Cu2+的位点(电荷密度远高于荚膜中)无法结合Cu2+离子(图6).因此,用0.3mol·L-1HC1进行预处理以去除细菌表面的荚膜结构,可以使细胞外膜和肽聚糖层上的大量负电荷基团充分和Cu2+结合,从而提高对Cu2+离子的吸附能力.当用碱液或浓酸处理会彻底破坏细胞表面结构和成分,使吸附能力降低.
2.4 组合生物处理系统对废水中Cu 的去除
组合生物处理系统中的半连续生物吸附装置用于去除废水中的Cu2+.收集在硫限制培养基中培养36h的P.putida 5-x细胞(干重为0.2g),使用0.3mol·L-1HC1预处理后的菌体作为生物吸附剂,经5次吸附一再生一吸附循环使用.含不同浓度Cu2+的城市污水经生物吸附装置处理后的结果,见表4。5次吸附循环中该生物吸附剂对不同浓度Cu2+的吸附率都在95%左右,处理后废水中的Cu2+浓度降低到0.46~1.27mg·L-1,表明经过优化条件制备的P.putida 5-x细胞对Cu 的吸附能力增强,再生4次后的吸附效果基本保持不变.细胞的再生回用可以减少吸附剂用量从而减少污泥量和运输费用,降低了生物吸附的成本.因此该生物吸附剂是一种适合于实际应用的优良的Cu 吸附剂。
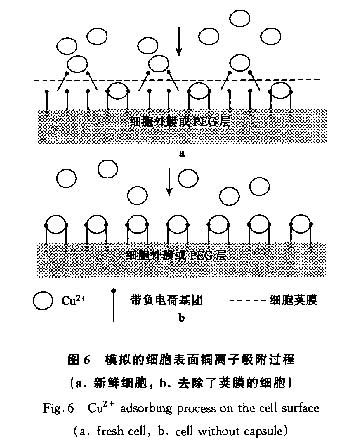
表4 组合生物处理系统中的生物吸附部分的运行结果
Table 4 Results of bio-adsorption of combined bio-proc es
1)所有数据均为5次吸附一再生循环过程中的平均值
2.5 Cu2+浓度对活性污泥过程去除COD的影响
活性污泥处理过程中,有机物必须先吸附在活性污泥上,才能被微生物降解,因此活性污泥对COD 吸附能力下降,必将影响其对COD的降解效率.COD吸附容量(CAC)可以用来评价活性污泥吸附有机物的能力,CAC可定义为活性污泥和有机废水接触前5 min内废水中C0D的减少(因为生物降解过程是一个较缓慢的过程,前5
min的COD下降主要是活性污泥对废水中的COD吸附效应所致).污水中重金属离子的浓度较低时,一般不会对微生物细胞中的降解酶产生抑制,但由于重金属离子强烈的吸附竞争作用,活性污泥对有机物的吸附速率和能力仍将受到影响[18]。
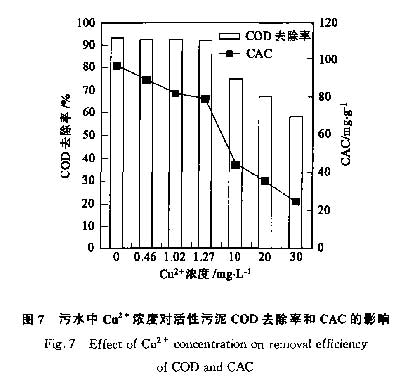
图7表示的是污水中不同浓度的Cu2+对活性污泥CAC值和COD去除能力的影响.随着污水中Cu2+浓度升高时,活性污泥的CAC值显著降低.经生物吸附后,原水中Cu2+浓度由10 mg·L-1,20mg·L-1,30mg·L-1分别降低到0.46mg·L-1,1.02mg·L-1,1.27mg·L-1.相应地,活性污泥的CAC值(COD)由44.2mg·g-1,35.7mg·g-1,24.6mg·g-1,44.2mg·g-1升高为89.5mg·g-1,81.8mg·g-1,78.9mg·g-1(图7).尽管生物吸附后活性污泥的CAC值比未吸附时升高,但是与不含Cu2+的相比,还是低了8% ~18%.当污水中Cu2+浓度为10mg·L-1,20mg·L-1,30mg·L-1时,COD去除率分别为74.4%,66.8%,57.9%.但生物吸附处理后,污水中Cu2+的浓度大大降低,SBR的COD去除率提到92%左右,和处理不含Cu2+时的去除率基本一致.这些结果表明,生物吸附后污水中的微量Cu2+依然对活性污泥的CAC存在影响,但对COD
去除率不再有显著抑止作用.进一步说明,微量的Cu2+对微生物细胞的代谢酶无毒害作用,但对有机物在活性污泥菌胶团表面的吸附竞争仍然存在.这种竞争虽然对活性污泥吸附有机物不利,但对SBR工艺去除COD已基本没有影响,尤其当水力停留时间(HRT)较长时(HRT>>5min)影响甚微[18].实验结果说明,使用P.putida 5-x细胞作为生物吸附剂去除污水中的Cu2+以提高污水的可生化性是相当有效的.
将该组合生物处理系统与单独的SBR工艺对比,各自处理含Cu2+的有机废水的结果见表5.结果显示,组合生物处理系统处理后出水中的Cu2+和C0D浓度远低于单一SBR法.说明使用生物吸附一生物降解组合处理系统可以有效处理含重金属离子的城市污水.
表5 组合生物处理系统与单一SBR的比较/mg·L-1
Table5 Comparition of combined bio-process and SBR/mg·L-1
3 结论
采用生物吸附一SBR组合的处理工艺可有效处理含Cu2+的城市污水.P.putida 5一x菌体经硫限制培养基培养,并在培养36h后收集,经0.1~0.3mol·L-1 HC1洗涤后作为生物吸附剂,可得到最佳吸附效果.透射电镜分析指出,酸洗预处理由于去除了细胞荚膜,提高了细胞对Cu2+的吸附能力.新鲜细胞和酸预处理细胞对Cu2+的吸附过程是物理吸附过程,遵从Freundlich吸附等温线.经P.putida 5一x细胞的生物吸附处理后,污水中Cu2+浓度降到微量级,对SBR去除COD已无明显影响,但对菌胶团吸附有机物尚存在较明显的吸附竞争.与单独SBR相比,组合生物处理系统更适合处理含重金属离子的城市污水.
参考文献:
[1] Battistioni Paolo,Fava,Gabriele,Letizia Ruello Maria.Heavy metal shook load in activated sludge uptake and toxic effects[J].WaterRes·,1993,27(5):821~827. [14]
[2] Codina J C,Peres.Garcia A.Vicente A D.Detection of heavy metal toxicity and genotoxicity in wastewater by microbial assay [J].Water Sci.Techno1.,1994,30(1):145~151.
[3] Environmental Protection Department.Standards for Effluents . Discharged into Draining and Sewerage System [M ].Hong [15] Kong Government:Hong Kong ,1991.
[4] Sag Y,Nourbakhsh M,Aksu Z,et a1.Comparison of Ca-algi- 16] nate an d immobilized Z.ramigera as sorbent for Cu2 removal [J].ProcessBiotech.,1995,30(2):175~181.
[5] Hung Chih-Pin,Huang Chin—Pao,Morehart Allen L.The re.moval of Cu(1I)from dilated aqueous solutions by Saccha一[17] rornyces cerevisiae[J].Water Res.,1990,24(3):433~439.
[6] Kratohvil Daved,Volesky Bohumil Biosorption of Cu from ferruginous wastewater by algae biomass[J].Water Res. 1998,32(12):2760~2768.
[7] Andres Y,Maccordick H J,Hubert J C.Adsorption of several actinide(Th,U)and lanthanide(La,Eu.Yb)ions by Mycobac. terium smegmatis[J].App1.Mirobio1.Biot.,1993.39(3): 413~417.
[8] Volesky B. Advances in biosorption of metals:selection of biomass types[J].FEMs Microbio1.Rev.,1994,14(3):291—302.
[9]Wong P K.So C M.Cu2 accumulation by a strain of Pseu. domonasputida[J].Microbiology,1993,73(2):113-121.
[10]ChHaH .W ong P K,Yu PH F,LiX Z.Removal an d recovery of copper ions from wastewater by magnetic immobilized cells of P.putida 5.x[J].Water Sci.Tech.,1998,38(2):315~ 322.
[11] Kwok E S C.Accumulation of nickel(Ni )by immobilized cells of Enterobacter sp.Master thesis[M].Hong Kong:The Chinese University of Hong Kong,1990.
[12] Hong K,ChenGQ,YuPH F,ZhangG,LiuY,ChuaH.Ef-Iect of C:N molar ratio on monomer composition of polyhydrox-yalkanoates produced by Pseudomonas mendoina 0806 an d Pseudomonas pseudoalkaligenus Ys1[J].App1.Bioehem.Biotech.,2000,84-86(9):971~980.
[13] Lee M H.Bradley M T.Surface charge properties of and Cu2+ adsorption by spores of the marine Bacillus sp.Strain SG-1[J]. App1.Envrion.Microbio1.,1998,64(5):1123~1129.
[14] Kotrba Pavel,Doleckova Lucie,De Lorenzo Victor,Ruml Tomas.Enhanced bloaccumulation of heavy metal ions by bacte-fial cell due to surface display of short metal binding peptides[J].Applied and Environmental Microbiology,1999,65(3):1092~ 1098.
[15]Brierley C L.Metal immobilization using bacteria[M].New York:McGraw—Hill Book Co.,1991,303~324.
[16]Sag Y,Kutsal T.Biosorption of heavy metals by Zoogloea ramigera: use of adsorption isotherms an d a comparison of biosorption characteristics[J].Chemical Engineering Journal and Biochemical Eng ineering Journal,1995,60(2):181~188.
[17]Geesey C-G,Jartg L.Interactions between metal ions and capsu—lar polymers[M].New York:John Wiley and Sons,1989,325—357.
[18]Chua H ,Yu PHF,Sin SN,et a1.Sub—lethal effects of heavy metal on activated sludge microorganisms[J].Chemosphere, 1999,39(15):2681~2692.
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 [email protected] ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








