高铁酸盐预氧化对藻类细胞的破坏作用及其助凝机理
刘伟 马军
摘 要 利用电子显微镜和紫外分光光度计检测发现,高铁酸盐对水中藻类细胞的表面结构有很大影响,破坏了细胞的表面鞘套。高铁酸盐的氧化作用导致的藻类细胞的鞘套破裂使其向水中释放出胞内物质,这些生物高聚物能够在混凝过程中起到助凝剂的作用。高铁酸盐分解后产生的氢氧化铁胶体沉淀在藻类细胞的表面,也降低了藻类细胞的稳定性。
关键词 高铁酸盐;氧化;藻类;胞内物质;助凝
Effects of ferrate (Ⅵ) preoxidation on the architecture of algae cells and the mechanism of enhanced coagulation
LIU Wei, MA Jun
Abstract The scanning electron microscopy (SEM) and the ultraviolet spectro-photometer were used to measure the impact of ferrate (Ⅵ) preoxidation on the architecture of algae cells and the release of soluble organic matters from the cells. The results showed that ferrate (Ⅵ) preoxidation induced a number of clearly discernible effects on cell architecture, caused severe damage of cell layer. An excessive release of intracellular components into the surrounding media was also observed, which is possibly caused by ferrate stimulation or cleaved sheath by its oxidation. These biopolymers secreted in response to ferrate oxidation behave as a coagulant aid in coagulation process. Fe(OH)3 colloids derived from the decomposition of ferrate (Ⅵ) may precipitate on the surface of algae cells and thus decrease the stability of algae cells.
Keywords Ferrate (Ⅵ); oxidation; algae; intracellular organic matter; coagulant aid
湖泊与水库是常用的地表水水源,其中含有大量的浮游生物。近年来,由于水体污染严重,在河流中也出现了藻类含量升高的情况。含藻水混凝困难,不易形成良好的絮体,沉淀效果差。水中的一些藻类能引起嗅味,影响饮用水的感官性状;一些藻类会堵塞滤池,还有的藻类由于形体细小,可能会穿过滤池,造成滤后水的水质恶化。
前期的研究结果表明,高铁酸盐预氧化能够有效地去除水中的藻类细胞[1],高铁酸盐预氧化可以大幅度降低腐植酸对藻类混凝去除的阻碍作用[2]。试验中通过镜检发现,水中的藻类细胞经过高铁酸盐氧化后发生了结构和形态的变化,如藻类细胞表面被破坏,发生一定程度的聚集。在试验中我们采用的原水藻类含量较高[1],约为8.28´106-2.26´107个/升,高铁酸盐投量则相对较低,为0.14-1.40mg/L [以(Fe)计],因此高铁酸盐预氧化后藻类去除率的大幅度提高不可能是单纯氧化灭活作用所致。高铁酸盐对藻类具有氧化灭活作用的同时还可能存在着有利于后续混凝的作用。为进一步探讨高铁酸盐氧化除藻的机理,我们采用电子扫描显微镜考察藻类细胞经过高铁酸盐氧化后同正常细胞相比是否发生形态及结构变化,并测定处理前后水样的紫外吸光度和高锰酸盐指数,考察水样中溶解性有机物的变化规律。
1. 试验过程和方法
1.1 藻类培养
为了消除水中其它因素对高铁酸盐预氧化除藻效果的影响,试验所用藻类为人工培养。取含有夏季地表水中常见的绿球藻(Chlorococoam)和栅列藻(Scenedesmus)的湖水进行分级培养。首先配制适合两种藻类生长的培养液,在小容积的玻璃容器中培养一段时间,在其藻类细胞浓度较高时转移至大容器中继续培养。无机培养液的浓度见表1,培养液中同时加入少量的土壤渗出液以刺激藻类的生长。培养温度为15±1℃,起始pH 7.3,采用白炽灯和日光灯持续照明。每隔一天时间向容器中通入含1%CO2的混合空气,以保证藻类光合作用的需要。在25天的培养后,培养液中的藻类细胞浓度为3.5-4.2´108个/升,pH 9.1,浊度20-40NTU。
表1 藻类培养液中各种无机盐类的浓度
无机盐
KNO3
Ca(NO3)2
MgSO4·7H2O
KH2PO4
FeCl3
浓度 (mg/L)
20
60
20
20
0.2
注:培养液中混合有0.7%的土壤渗出液。其制备方法是取1kg土壤,加入1L水煮沸60min,冷却后沉淀,过滤后即为制得的土壤渗出液。
1.2 电子显微镜观察
将未处理水样(原培养含藻水)和处理后水样(原水中加入高铁酸盐5mg/L氧化30min)各取一滴在干燥台上,干燥2h。然后用Eiko IB-3型电子发射器向干燥后的水样上镀150nm的黄金。用Hitachi S-520型电子扫描显微镜观察,加速电压为15KV,并将藻类细胞显微照相以进行对比。
1.3 烧杯搅拌试验
静态试验在DBJ-621型六联定时搅拌器上进行。将含藻水转移至5个500 mL的烧杯中,用0.1N的HCI将原水的pH调至7.1。投加一定量的高铁酸盐 [以K2FeO4计],以200r/min的转速搅拌一定时间,再投加一定量的混凝剂 [以Al2(SO4)3·18H2O计],继续以200r/min的转速搅拌1min,然后以40r/min的转速搅拌10min,静置20min,然后测定水样的UV254吸光度和高锰酸盐指数。高铁酸盐固体由改进的化学氧化法制备,主要成分为高铁酸钾。由于制备过程中加入了无机稳定剂,该药剂可以稳定保存6-8个月,在水溶液中可以保持10h不分解,满足使用要求。使用前配制成1g/L的使用液,根据前期试验结果选择投量5mg/L。
取一系列500mL水样,进行单纯高铁酸盐氧化(氧化时间1h)、单纯硫酸铝混凝、高铁酸盐预氧化(氧化时间1h)后用硫酸铝混凝等不同的静态搅拌试验(搅拌试验工艺同上),处理后水样经过0.45 mm的滤膜过滤,然后在200 nm-320 nm波长范围内进行紫外扫描。
2. 试验结果与讨论
2.1 电子显微镜扫描结果
显微镜中观察到培养液背景纯净,藻种比较单一,主要为绿球藻和栅列藻。典型的栅列藻(Scenedesmus)如图1a所示:每个单体具有4个细胞,在外侧的两个细胞的尾端并生着两根长刺。4个细胞尺寸几乎相同。栅列藻的整个细胞体被鞘套包裹(这是指图中的网状外层)[3],可以清楚地看到细胞表层上的瘤状突起,这也是栅列藻的典型表层结构。每个细胞表面沿纵轴方向的条痕也清晰可见。绿球藻(Chlorococoum)活体细胞呈椭圆形,细胞体外对生的长刺有规律地分布在细胞周围(图1b)。图中的两种藻类细胞与在镜检过程中观察到的活体细胞相比有一点收缩,这是由于扫描电镜检测的前处理(干燥过程)造成的。
由高铁酸盐氧化前后藻体细胞的电子扫描显微镜对比结果可以看出,高铁酸盐预氧化对藻体细胞结构造成了明显的影响。高铁酸盐氧化处理促使藻体细胞向周围的介质中释放了大量的胞内物质(图2a, 图3a)。这种现象可能是由于高铁酸盐刺激了藻体细胞(图3a),造成其过度分泌胞内物质;或者是氧化破坏了细胞的鞘套(图2a)使其外壳开裂,从而造成藻类细胞胞内物质的外流。
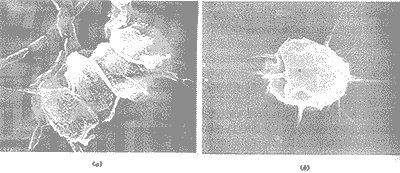
(a)四细胞的栅列藻,尾端细胞长有长刺;(b)绿球藻周围规律地排列对生长刺。放大倍数:(a) ×4000; (b) ×8000。
图1 未处理的藻类细胞
高铁酸盐氧化对藻类细胞的另一个破坏作用就是造成了外部鞘套的强烈卷绕。显微照片的(图2b, 图3a)测定结果表明,高铁酸盐预氧化使细胞表面结构受到严重破坏,原来栅列藻(Scenedesmus)的瘤状突起排列消失,外部鞘套受到破坏;而绿球藻(Chlorococoum)在氧化后细胞体塌陷,外部的长刺脱落。

a)释放胞内物质;(b)外部鞘套卷绕;(c)Fe(OH)3胶体沉淀在藻细胞表面。放大倍数:(a) ×4000; (b) ×4000; (c) ×6000。
图2 高铁酸盐预氧化处理后的栅列藻细胞
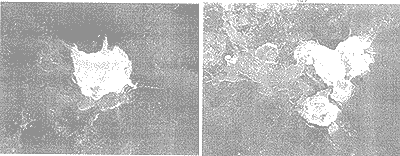
(a)释放胞内物质;(b)细胞的聚集。放大倍数:(a) ×7000; (b) ×4000。
图3 高铁酸盐预氧化处理后的绿球藻
上述高铁酸盐氧化对藻细胞的两种影响可能同时存在,即高铁酸盐氧化首先造成藻细胞体外壳的卷绕,并刺激其过度分泌胞内物质,进一步的氧化作用会使细胞鞘套开裂致使胞内物质大量外流。
高铁酸盐预氧化的特点是分解后会形成氢氧化铁胶体沉淀 [Fe(OH)3]。图2c显示氢氧化铁胶体沉淀到藻类细胞表面的情况,这些沉淀显然会改变藻类的表面性质,如藻细胞的表面电性。一旦这些沉淀物吸附到藻细胞的表面,它们就降低了藻细胞的活动性,而且增加了藻细胞的沉淀性。高铁酸盐预氧化后部分藻细胞发生聚集(图3b)。从显微摄影结果可以看出,藻细胞释放的胞内物质使它们发生聚集,Fe(OH)3沉淀的絮凝作用也会促进这种聚集作用,或者是这两者协同作用结果使藻类细胞在混凝之前就发生初步的凝聚,从而易于被硫酸铝混凝沉淀。
从电子显微镜的扫描照片可以看出,高铁酸盐预氧化给藻类细胞的表面结构带来了一系列影响,破坏了藻细胞外部鞘套,造成细胞内物质向周围介质的释放,并改变其沉降性能。藻类的混凝、沉淀是基于硫酸铝水解产物的电中和原理,除了藻细胞的表面电性,水中的溶解性有机物也是影响混凝效果的重要水质因素。高铁酸盐氧化造成的藻类细胞的胞内物质释放必然使水中的有机物浓度或者数量发生变化。
2.2 水中溶解性有机物的变化
将原水和处理过的水样经0.45mm的醋酸纤维膜过滤后在200nm-320nm波长范围内紫外扫描,测定紫外吸光度(UVA)。紫外的吸光度(254nm波长)是水中天然有机物(NOM)的良好替代参数。在水处理中,波长254nm处的吸光度值被用于近似地反映水的溶解性有机碳(DOC)[4]。紫外扫描结果可以反映水中天然有机物的芳香化程度。在试验中UVA和UV254用于指示处理前后水样的溶解性有机物(DOM)的浓度变化。
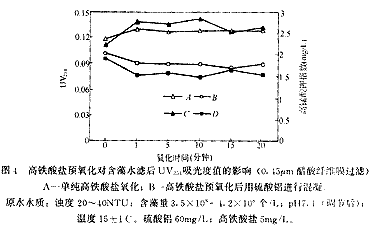
图4是在不同氧化时间下,经过和不经过硫酸铝混凝处理含藻水UV254吸光度和高锰酸盐指数变化情况,时间0点为不投加高铁酸盐的情况。可以看出,含藻水的UV254吸光度值在很短的氧化时间内有较大的升高,但随着氧化时间的延长吸光度变化不大。高铁酸盐预氧化后用硫酸铝混凝沉淀后UV254值低于单纯硫酸铝混凝,同样随时间的延长变化不大。高锰酸盐指数也表现出同样的变化规律。一些研究者在使用氧化剂从污水中去除藻类时发现溶解性有机碳(DOC)升高的现象[5-6],使用O3、ClO2和Cl2等处理含藻水也会使DOC及UV254升高[7]。高铁酸盐预氧化使水样UV254和高锰酸盐指数升高说明氧化作用可能增加了含藻水中有机物含量或者数量,经过硫酸铝混凝后这些指标下降说明混凝过程可以去除这些增加量,并且低于单纯硫酸铝混凝。
从图中曲线的形状可以看出,短时间(1分钟)内的氧化就使UV254和高锰酸钾指数发生较大变化,说明高铁酸盐的氧化造成藻细胞释放胞内物质的过程在很短的时间内就可以完成。试验中高铁酸盐的特征紫色在10分钟内才完全褪去,这说明高铁酸盐的部分氧化性被水中的其他还原性物质(如有机物)所消耗,高铁酸盐可能会氧化藻细胞释放的胞内物质。
A-单纯高铁酸盐氧化;B-高铁酸盐预氧化后用硫酸铝进行混凝。原水水质:浊度 20-40NTU;含藻量3.5×108-4.2×108 个/L;pH 7.1(调节后);温度15±1℃。硫酸铝 60mg/L;高铁酸盐5mg/L。
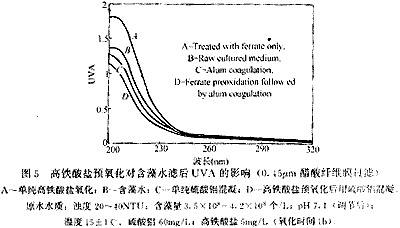
与图4相同,在波长为200nm-320nm之间的紫外扫描值也表现出同样的变化规律(图5)。经过高铁酸盐氧化后水样的紫外吸光度值整体升高,尤其是在200nm-250nm波长范围内升高的幅度较大。硫酸铝混凝处理后UVA有一定程度的下降,但是幅度不大。高铁酸盐预氧化后用硫酸铝混凝则使UVA显著下降,低于单纯硫酸铝混凝。多数有机物在紫外区间都有吸收,紫外吸光度值曲线的整体升高说明高铁酸盐氧化后藻类细胞可能释放出多种有机物而不是一种物质。一般来说,200nm-250nm波长范围内的强吸收带可能是由于存在双键并处于共轭状态,高铁酸盐氧化可能使水中带有双键基团(如羰基等)的有机物浓度或数量增加,这些有机物可能是来自藻类细胞释放也可能是高铁酸盐氧化有机物后生成,它们可能会被后续的混凝去除,因而高铁酸盐预氧化后用硫酸铝混凝水中的溶解性有机物(DOM)进一步降低。
Herth[8-10]报道几种绿藻能够向水中释放出几丁质纤维,另外藻类细胞还可能释放出除几丁质之外的其他有机物质。这些绿藻或者蓝绿藻释放出的胞内物质在水中会具有带负电荷或中性多聚电解质的性质,并因此而具有一定的絮凝作用。
高铁酸盐预氧化对水中藻类细胞的作用机理可能是:高铁酸盐预氧化能够破坏藻细胞的表面结构,造成藻细胞表面鞘套的卷绕,并可能使细胞的外鞘开裂,致使胞内物质外流。高铁酸盐分解后产生的氢氧化铁胶体也可以被吸附在一些藻类细胞表面,在降低细胞的表面电荷的同时也增加了这些细胞的沉淀性。氢氧化铁胶体的吸附和胞内物质的絮凝作用在混凝之前就能够使部分藻类细胞发生凝聚,胞内物质在混凝过程中还可能进一步起到助凝剂的作用。这是高铁酸盐预氧化具有优良除藻效果的重要原因。
A-单纯高铁酸盐氧化;B-含藻水;C-单纯硫酸铝混凝;D-高铁酸盐预氧化后用硫酸铝混凝。原水水质:浊度 20-40NTU;含藻量3.5×108-4.2×108 个/L;pH 7.1(调节后);温度15±1℃。硫酸铝 60mg/L;高铁酸盐5mg/L(氧化时间1h)。
3. 结论
电子显微镜的观察结果表明,高铁酸盐预氧化能够改变水中藻类细胞的表面性质,破坏细胞表面结构,并刺激胞体向其周围的介质中释放出胞内物质。紫外扫描测定结果表明,高铁酸盐预氧化能增加水中有机物浓度。这些胞内物质具有大分子结构,在混凝过程中可能起到助凝剂的作用。另外,高铁酸盐分解后产生的Fe(OH)3胶体能够吸附并沉淀到藻细胞的表面,从而降低了藻细胞的稳定性。
参考文献
[1] 马军,石颖,刘伟,李圭白. 高铁酸盐复合药剂预氧化除藻效能研究[J]. 中国给水排水,1998, 14 (5):9~11.
[2] 马军,刘伟,盛力,李圭白. 腐植酸对高铁酸钾预氧化除藻效果的影响[J]. 中国给水排水,2000, 16 (9):5~8.
[3] Starhlin L. A. and Pickett-Heaps J. D. The ultra-structure of Scenedesmus (chlorophydeae). Ⅰ. Species with the “reticulate” or “wary” type of ornamented layer[J]. J. Phycol., 1975, (11): 163-185.
[4] Owen D. M., Amy G. L., Chowdhury Z. K., Paode R., McCoy G. and Viscosil K. NOM characterization and treatability[J]. J. AWWA, 1995, (87): 46-63.
[5] Betzer N. and Kott Y. Effect of halogens on algae[J]. Wat. Res. 1969, (3): 237-264.
[6] Echelberger W. F., Pavoni J. L., Singer P. C. and Tenny M. W. Disinfections of algae-laden waters[J]. J. sanit. Engng Div. Am. Soc. Civ. Engrs 1971, (172): 721-730.
[7] Sukenik A., Teltch B., Wachs A. W., Shelef G., Nir I. and Levanon D. Effect of oxidants on microalgal flocculation[J]. Wat. Res. 1987, 21(5): 533-539.
[8] Herth W. A special chitin-fibril-synthesizing apparatus in centric diatom[J]. Cyclotella. Naturwissenschaften, 1978, (65): 260-269.
[9] Herth W. The site of b-chitin fibril formation in centric diatomsⅡ. The chitin-forming cytoplasmic structures[J]. J Ultrastru. Res., 1979, (68): 16-27.
[10] Herth W., Bartholtt W. The site of b-chitin fibril formation in centric diatom Ⅰ.Pores and fibril formation[J]. J Ultrastru. Res., 1979, (68): 6-15.
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。









