认识消毒过程中的氧化还原电位
| 论文类型 | 技术与工程 | 发表日期 | 2000-10-01 |
| 来源 | 《Water Engineering & Management》1993年第11期 | ||
| 作者 | 何玲,译,姚芳宇,校 | ||
| 摘要 | Understanding ORP’s Role in the Disinfection Process 对氧化还原电位(ORP)的测量,在产水工艺中是一种有用的控制手段,但往往被人们所忽视而未能充分加以利用。ORP是一种溶液氧化能力的显示,与氧化剂的浓度及其电位或称强度有关。 在给水消毒中,已经证实了某溶液ORP值较之自由氯 ... | ||
Understanding ORP’s Role in the Disinfection Process
对氧化还原电位(ORP)的测量,在产水工艺中是一种有用的控制手段,但往往被人们所忽视而未能充分加以利用。ORP是一种溶液氧化能力的显示,与氧化剂的浓度及其电位或称强度有关。
在给水消毒中,已经证实了某溶液ORP值较之自由氯或总氯浓度更为有意义。这是pH值变化后,水中氯的两种形式之间平衡的结果。同时氯可与胺或稳定剂结合而生成一些影响总氯量的化合物,而这些化合物并无消毒作用。
水本身是一种很弱的氧化剂,这是由于水中几乎总是存在着溶解氧。实际上,氧就是一种弱氧化剂。试想水与低碳钢之间的反应,钢出现了腐蚀(氧化)。水的ORP值在200 至300mV之间。这个范围姑作“O”点,如添加能使氧化的药剂,可使ORP值升至300mV以上。溶液的ORP值可说明其氧化的能力或趋势。
ORP在1968 年已形成世界标准,当时德国联邦卫生局实验室首次证实埃希氏大肠菌的杀灭速度取决于ORP,而并非剩余自由氯。1972年,世界卫生组织颁布的饮用水标准认为ORP值为650mV即可做到对病毒细菌的瞬时消毒。
德国标准(DIN)规定游泳池中ORP最低值为750mV(1984年)。
水中的氯
当氯加入水中时,形成次氯酸(HOCL),这是一种强而且反应快的氧化剂,当pH提高时,次氯酸离解成OCL-离子(次氯酸离子),其反应较弱,较慢(见图1)。因此,当一种含氯溶液的pH值提高时,其氧化能力减弱,这可由ORP读数反应出来。而单独监测自由氯自身的浓度并不反应这一点。同时,已与其它化合物,如胺相结合的氯也算作“总氯量”,而其氧化能力却很低。如目的在于测知氧化能力,那么,ORP则能真实测得这种能力。
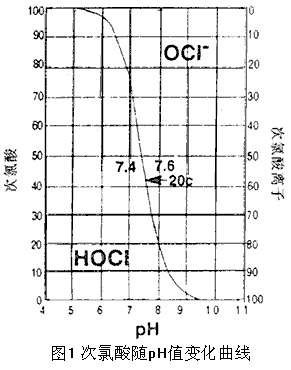
欲保持自由氯的最具活力的形式,pH值应保持在7.4-7.6之间,如上升到8.0,那么80%的自由氯即离解成次氯酸离子形式。作为氧化剂,其氧化能力就会视菌类不同,只有300分之一了。我们可以看出仅用自由氯的概念不能保证消毒效果ORP只测量总氧化能力,与pH值、氯的浓度和氯存在的形式无关。ORP在650mV时,可出现可埃希氏大肠菌的瞬时杀灭,无论是否pH7.6时,自由氯在0.3ppm,或是pH7.8时,自由氯在0.4ppm,其结果都一样。
所用的氧化剂是次氯酸钠(NaOCL)时,pH值对氯浓度和ORP的影响就会增大。这种常见液态形式通常可使溶液的pH值上升达到13-13.5。如加入中性水溶液时,其pH值很快升高。PH本身是对数性质,当pH接近7.0(中性)时,变化非常快。然后每一个数变化速度放慢1/10。由于HOCL/OCL-的平衡关系影响氧化反应,事实上最初向水中投加次氯酸钠可引起氧化能力的降低,除非用酸中和碱度。为此,在用次氯酸钠消毒时,pH 的控制是非常重要的。
从表1和表2可以看出溶液中次氯酸钠对pH 和ORP值的碱度的影响。表1所示为当12%的NaOCL溶液加入水中时的数值。请注意开始投加NaOCL时pH值的变化是很快的。当pH上升后,由于不活跃的OCL- 形成,因此ORP减弱了。
表2所示为用2%NaOCL溶液所得的值,即投加硫酸以中和碱度和降低pH值。虽然自由氯浓度没有变化,但该溶液的氧化趋势显著增加。
需氯量
水处理工艺中欲得到剩余氯,所需的投氯量取决于水中的细菌和其它有机废物数量的多少。氨化合物与氯结合生成一氯胺转化为二氯胺,这种物质是造成氯味以及通常驻在公共游泳池内导致眼睛发炎的主要原因。由于仍有更多的氯继续投加,二氯胺也可能由于转换成氮和盐酸被破坏掉。这就是叫做折点加氯的折点。欲达到折点加氯,需要的氯与氮化物的比率为10:1。
对这一工艺如采用ORP电子控制,可迅即做到氨化物的折点加氯,杀灭细菌。ORP控制可使溶液的氧化能力保持在反应所需的范围内。ORP用做连续监测与控制时,可立即测知氧化能力已否消失,并自动再投氯。
其它氧化剂
其他常见消毒氧化剂有次氯酸钠、溴和臭氧。根据定义,氧化剂应是一种能供给电子的化学药剂。在溶液中,氧化剂会提高ORP的值。氧化剂浓度越大,氧化速度也就越快。
实际上ORP 取决于氧化剂的浓度及其活性。表3所列为常用氧化剂及其与氯相比较的氧化趋势。有一点可以看出,即臭氧的活性是氯的一倍半,在氧化工艺中,欲得到一定ORP值,每一分子量所需的臭氧较少。反映氧化速度的不是氧化剂的浓度而是ORP。
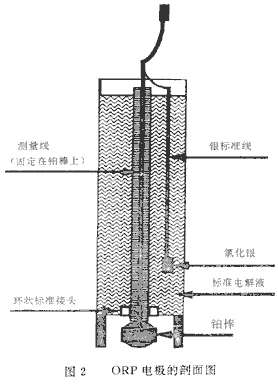
测量ORP与测量pH值的方法相似。铂对电子活性的敏感程度与玻璃电极对氢离子存在的敏感程度相同。在典型的ORP传感器中的电极几乎完全与pH电极一样,铂接触面(通常为铂棒或铂条)为测量电极,在氯化钾标准电解液中的银/氯化银标准线为参考电极(图2)。
可以把电极看作一个电池,电压从测量侧流向标准液侧。标准液与被测溶液电路接通。为此,参考极接头部分必须保持清洁和流畅。
ORP电极的保养也可仿效pH测定仪的做法,例如,该电极必须始终浸在溶液中,需定期清洗并校正电极的变化。视使用情况每隔一、两年更换电极一次。
清洗ORP电极最好用5%的盐酸溶液。这种溶液对硬水可能沉积在接头处的物质能有效地溶解掉。为使标准电解液能将标准电压输回溶液,保持标准接头畅通是很重要的。
校正应该是一种经常工作。一般是每月一次。校正最好的办法是使用现制的饱和至pH为4.0到7.0缓冲液的氢醌溶液。氢醌是一种弱还原剂,其活性随pH大小而变化。将其加入已知pH值的溶液中,即可产生87mV (pH7.0) 和264mV (pH4.0) 这一标准的ORP溶液。这些溶液被用来监测在规定时间之外电极出现的偏移和距离变动。
在夏季历来的方法是测量余氯或臭氧,而并不重视测量ORP。但最近研究提出:ORP应考虑为氧化能力(或称消毒)的主要指标。现场ORP的控制,可确保欲处理水中存在的细菌或氨化合物能及时快速地消灭掉,保障人类的饮水安全。
译自1993年第11期(Water Engineering & Management)
何玲译 姚芳宇校
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 [email protected] ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








